NOMENCLATURA BETHESDA 2001
El sistema Bethesda para informar los resultados de la citología de vagina y cérvix uterino es la nomenclatura citológica más aceptada universalmente, adoptada por la Academia Internacional de Citología, Sociedad Española de Citología y otras 40 Sociedades profesionales. La clasificación de las anomalías glandulares de la Nomenclatura Bethesda 2001 queda reflejada en la tabla 1. Las principales decisiones adoptadas en la conferencia, que afectan al epitelio glandular son las siguientes: El término AGUS (células glandulares atípicas de significado indeterminado) ha sido revisado siendo eliminada la clasificación de «significado indeterminado» para evitar la confusión con ASCUS. El término «células glandulares atípicas» transmite al clínico una información más específica. La calificación «posiblemente reactivas» también ha sido eliminada, conservándose «posiblemente neoplásicas».

La descripción de las alteraciones citopatológicas del endocérvix la vamos a realizar clasificándolas en tres apartados: lesiones benignas, células endocervicales atípicas y lesiones malignas.
I. LESIONES GLANDULARES BENIGNAS DEL ENDOCÉRVIX
1. Pólipo endocervical
Su diagnóstico citológico específico es difícil, especialmente si el pólipo es de tipo fibroso. En la anterior clasificación de Bethesda se clasificaban como A.G.U.S. posiblemente reactivo y en la 2001 como células endocervicales atípicas. Los extendidos muestran un incremento de células endocervicales benignas, unidas a metaplásicas, en grandes placas, formaciones glandulares y acinis polipoideos (fig. 1).

Fig. 1. Citología de pólipo endocervical.Las células endocervicales pueden presentar marcado agrandamiento e hipercromasia nucleares y nucleolos prominentes, criterios que pueden ser observados en lesiones malignas.
2. Endometriosis cervical
Lesiones que presentan glándulas y estroma endometriales ectópicos, que responden a las hormonas ováricas, igual que el endometrio. Los extendidos muestran sangre fresca y vieja, macrófagos con hemosiderina y células endometriales, glandulares y del estroma (fig. 2).

Fig. 2. Endometriosis de cérvix: extendido cervical.
En los últimos años se ha producido un incremento diagnóstico, que llega al 2,5% en algunas series (3), debido al aumento de las tomas de endocérvix y a las nuevas tomas de cepillado endocervical. Es importante conocer que en estos cepillados, sobre todo con Cytobrush (Hanau y Bibbo, 1997) (3), se observan fragmentos con pseudoestratificación y protusión de los núcleos, pleomorfismo, hipercromasia y amontonamiento, y cromatina en sal y pimienta, que recuerdan al adenocarcinoma de endocérvix.
Histopatología: Los rasgos citológicos se confirman, con depósitos en el estroma, bajo la zona de transición (fig. 3).

Fig. 3. Endometriosis de cérvix: histopatología del caso anterior.
Diagnóstico diferencial: En la tabla 2 presentamos los caracteres diferenciales con los procesos más comunes: adenocarcinoma de endocérvix, proceso de reparación y células endometriales sin patología endometrial (4).
3. Hiperplasia microglandular
Es una proliferación de tejido glandular endocervical cuya mayor incidencia se encuentra en pacientes con embarazos recientes o tomadoras de contraceptivos orales (67% Young y Scally) (5).
El cuadro citológico de la hiperplasia microglandular ha sido descrito por Carmen Alvarez (6) y muestra en las células endocervicales cambios reactivos benignos, con citoplasmas vacuolizados y grupos bi y tridimensionales (fig. 4). Es característico la existencia de microluces por células glandulares y espacios defenestrados. También se identifican células metaplásicas maduras y células subcilíndricas de reserva.

Fig. 4. Hiperplasia microglandular del cérvix.
Tiene importancia conocer la existencia de pacientes con hiperplasia microglandular atípica, cuyos marcados cambios reactivos pueden dar lugar a falsos + y cuadros de AGC. Los núcleos están agrandados, con anisonucleosis, cromatina irregular y macronucléolos. El citoplasma vacuolizado puede presentar imágenes en anillo de sello.
Diagnóstico diferencial: La tabla 3 muestra los signos más característicos para diferenciar la hiperplasia microglandular atípica del adenocarcinoma in situ de endocérvix, el adenocarcinoma endocervical invasor y el adenocarcinoma endometrial invasor.
4. Células cervicales reparativas
El proceso reparativo puede afectar no sólo a las células endocervicales sino a las metaplásicas y parabasales. Se caracteriza por su presentación sincitial, con grandes nucleolos, asociados a diátesis inflamatoria, mientras en las células malignas, la cromatina es muy irregular con abundante diátesis tumoral.
5. Células Arias Stella
Las células de Arias Stella son infrecuentes en extendidos citológicos. Las alteraciones descritas afectan comúnmente a las células del endometrio, pero pueden también localizarse en endocérvix (7) y trompa de Falopio. Suelen presentarse en pacientes gestantes, rara vez después de anovulatorios orales y drogas inductoras de la ovulación.
La morfología de las células de Arias Stella es característica: citoplasma abundante, con microvacuolización y PAS+ y marcadas atipias nucleares: aumento de tamaño, pleomorfismo, hipercromasia. Son células poliploides, nunca aneuploides.
El diagnóstico diferencial de las células de Arias Stella se plantea con el adenocarcinoma, principalmente el de células claras: nos es útil la ausencia de estratificación y amontonamiento. Como norma práctica sugerimos que el adenocarcinoma sea diagnosticado con cautela durante el embarazo (8).
6. Núcleos desnudos endocervicales
Un cuadro de etiología no característica, pero no infrecuente, es la presencia de núcleos desnudos de citoplasma endocervicales, en mujeres post-menopáusicas, que adoptan tamaño variable y forma uniforme. La presencia de una cromatina blanda y la ausencia de nucleolo, los distingue del adenocarcinoma, aunque debemos ser cautelosos y no diagnosticar esta última entidad con sólo núcleos desnudos.
II. CÉLULAS ENDOCERVICALES ATÍPICAS
En la Nomenclatura de Bethesda 2001, bajo la categoría de «anomalías de células glandulares» se considera:
Células endocervicales/endometriales atípicas (sin cualificar).
Células endocervicales/glandulares atípicas, posiblemente neoplásicas (especificar en descripción).
Las células glandulares atípicas deben de ser calificadas como endocervicales o endometriales, siempre que sea posible, como ocurre en la mayoría de los casos. Si no es posible, se referirán como glandulares.
Se incluye en el término A.G.C. aquellas situaciones con importantes anomalías de las células glandulares que sugieren neoplasia pero no tienen todos los criterios del adenocarcinoma in situ o invasor, exigiendo un riguroso estudio con colposcopia y estudio histopatológico endocervical y también endometrial si es paciente de más de 40 años o presenta metrorragias (fig. 5).

Fig. 5. Células endocervicales atípicas (AGC).
III. LESIONES MALIGNAS ENDOCERVICALES
De forma pragmática hemos clasificado las lesiones citopatológicas malignas del endocérvix en cuatro grupos: adenocarcinoma in situ, adenocarcinoma invasor, tumores infrecuentes y tumores metastásicos (tabla 4).
1. Adenocarcinoma endocervical in situ (AIS)
En la clasificación de Bethesda 2001 ha sido considerado como entidad independiente, con caracteres citomorfológicos propios.
Histopatología: Conserva el patrón de criptas endocervicales normales, con afectación parcial de las mismas, donde se observa una transición abrupta del epitelio. Generalmente único. El epitelio glandular muestra aumento de tamaño y polimorfismo nucleares (fig. 6).

Fig. 6. Histopatología del adenocarcinoma endocervical in situ.
A menudo se asocia a lesiones intraepiteliales pavimentosas y a veces al carcinoma epidermoide invasor, con infravaloración de la patología glandular.
Citología: En las tablas 5 y 6 presentamos los caracteres arquitecturales y del núcleo, y el fondo limpio, sin diátesis tumoral del cuadro citológico del adenocarcinoma endocervical in situ (fig. 7). Es importante la distinción con las lesiones escamosas intraepiteliales. Como datos característicos se han descrito el denominado feathering, aspecto de plumas, con protusión de los núcleos que salen del citoplasma y la presencia de apoptosis, inclusiones en el centro de las células o grupo celular. Jawarski (9) lo identifica en el 73% de sus casos, aunque con frecuencia es irreconocible en los extendidos citológicos (10).

Fig. 7. Citología del adenocarcinoma endocervical in situ.
Precede varios años al adenocarcinoma invasor, manteniéndose asintomático. El no presentar evidencias colposcópicas limita su diagnóstico a la detección citológica y al estudio histopatológico de la zona de transformación.
Diagnóstico: El AIS suele ubicarse en los tramos altos del conducto endocervical, con localizaciones profundas endocervicales, debajo de los pliegues o del epitelio metaplásico, por lo que sólo se reconoce alrededor del 60% en los extendidos citológicos (Balagueró) (11).
Aunque la mayoría de los AIS se localizan en las zonas adyacentes a la unión escamo-columnar, la involución de la menopausia motiva el citado ascenso a las zonas más altas del conducto endocervical, por lo que el clásico legrado endocervical sólo biopsia la superficie de las criptas, pero no los focos profundos. Actualmente se aconseja por ello, conización diagnóstica.
2. Adenocarcinoma endocervical invasor
Citología: Debido a que el denominado adenocarcinoma endocervical microinvasor no tiene una aceptada definición ni cuadros histopatológico ni citopatológico, solamente nos vamos a referir al cuadro citológico del carcinoma invasor, que lo sintetizamos en la tabla 7 (fig. 8).

Fig. 8. Adenocarcinoma endocervical invasor.
Diagnóstico diferencial
1. Asociación con LIP. Es frecuente esta asociación siendo incluso más llamativas las lesiones pavimentosas intraepiteliales, lo que dificulta el diagnóstico glandular.
2. Adenocarcinoma endometrial. El diagnóstico diferencial entre el adenocarcinoma de endocérvix y el de endometrio presenta a menudo dificultades para identificar su origen, debiéndonos limitar al diagnóstico de adenocarcinoma uterino. Otras veces podemos sugerir su ubicación en endocérvix si observamos células malignas en empalizada, de forma columnar, con macronucléolos o en endometrio, cuando identificamos acinos o placas sueltas con células baloniformes.
3. Adenocarcinoma extrauterino. Debe sospecharse la posibilidad de un adenocarcinoma extrauterino si se observan estas tres características. a) escasas papilas de células malignas dispersas esporádicamente por el extendido. b) ausencia de diátesis tumoral y c) demostración de endometrio y endocérvix no maligno, mediante legrado fraccionado.
4. Carcinoma epidermoide de cérvix. En su forma intraepitelial (CIS), la ausencia de nucleolos y de diátesis tumoral ayuda en el diagnóstico. El tipo no queratinizante de células grandes es el que puede confundirse con el adenocarcinoma endocervical. Inclina a favor del primero su presentación en forma de sincitios o de células aisladas y la ausencia de empalizada.
3. Tumores infrecuentes
a. Glassy cell carcinoma
Descrito en 1956 por Glucksman y Cherry (12), representa el 1-2% de los carcinomas del cérvix y el 10% de los adenocarcinomas. Su mayor incidencia es en la 4.ª década, en mujeres más jóvenes que el carcinoma epidermoide y el adenocarcinoma de cérvix.
Concepto (OMS): Carcinoma pobremente diferenciado, con células de extenso citoplasma en «cristal esmerilado», bordes bien definidos y macronucléolos. Pueden presentar áreas menores de diferenciación glandular y escamosa. Algunos autores le consideran como una forma de carcinoma adenoescamoso poco diferenciado.
A.P.: Aspecto indiferenciado con cordones sólidos de células malignas:
Células tumorales: «cristal esmerilado» + macronucléolos + mitosis.
Estroma: infiltración eosinófilos + células plasmáticas.
Diferenciación glandular y escamosa (fig. 9).

Fig. 9. Histopatología glassy cell carcinoma.
Cuadro citológico: Extendidos hipercelulares, muy cohesivos, cuyas células tumorales se presentan en agregados sincitiales, grupos, placas y cordones con septos fibrovasculares. El citoplasma es anfófilo de bordes mal definidos y los núcleos grandes, de cromatina granular fina y macronucléolos (fig.10).

Fig. 10. Citopatología glassy cell carcinoma.
Diagnóstico: En los casos típicos el cuadro citológico es altamente sugestivo; en otras circunstancias se plantea el diagnóstico diferencial con el carcinoma no queratinizante, coriocarcinoma, melanoma y células reparativas. En estos casos es de gran utilidad la inmunocitoquímica: citoqueratinas, vimentina y CEA + y HMB-45 - (F. Smith) (13).
b. Carcinoma adenoescamoso
Es un tumor mixto con células glandulares y pavimentosas malignas y abundante diátesis tumoral. En las formas pobremente diferenciadas el componente mixto no es fácil de identificar.
c. Carcinoide
El carcinoma neuroendocrino de cérvix es raro. Las células malignas son pequeñas, con citoplasma escaso, que muestran gránulos neurosecretores (Grimelius +). Los núcleos son redondos y ovales, con nucleolo, cromatina en grumos y moldeamiento nuclear. Es habitual la diátesis tumoral.
d. Adenocarcinoma villoglandular de cérvix
Es un tumor que se presenta en mujeres jóvenes, con buen pronóstico y tratamiento conservador mediante conización cervical. El cuadro histológico presenta un patrón villoglandular, con moderada diferenciación celular y sin invasión de la pared cervical.
El extendido cervical muestra papilas y vellosidades con ligera atipia citológica, tiras con núcleos periféricos en empalizada y pseudoestratificación y bolas tridimensionales. Los núcleos son pequeños e hipercromáticos, con nucleolos ausentes o inconspicuos (fig. 11). El diagnóstico citológico no suele ser fácil, por posible confusión con adenocarcinoma endocervical in situ, CIS, células endometriales recogidas con Cytobrush y células endocervicales reactivas (Ballo y Silverberg) (14).

Fig. 11. Citología adenocarcinoma viloglandular (Atención Dra. Prieto).
4. Tumores metastásicos en el cérvix
El carcinoma metastásico en el cérvix uterino es muy raro. Cuando el tumor primario se origina en el tracto genital femenino, en la mayoría de los casos es de origen ovárico; en una menor proporción su origen es el endometrio.
En gran parte de casos de origen extragenital, los tumores se originan en el tracto gastrointestinal, seguido en frecuencia de mama, piel (melanoma maligno) y pulmón.
La posibilidad de una metástasis debe de ser considerada en las siguientes situaciones:
No diátesis tumoral.
Células tumorales en grupos, placas esféricas o papilas.
Ascitis.
Células tumorales diferentes de las células genitales.
Historia de cáncer, tratado o no, en un órgano vecino.
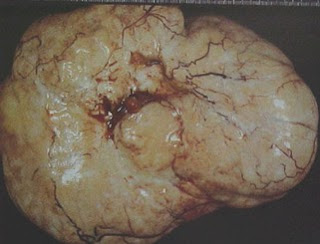
Kumar y Schneider (15) insisten en que cualquier mujer con metrorragia e historia de carcinoma previo, en particular de mama, estómago y colon, debe ser considerada en el diagnóstico diferencial de metástasis uterina, como infrecuente, pero posible diagnóstico. En raras ocasiones la metástasis en cérvix es la primera señal de una tumoración de evolución clínica solapada, como nos ocurrió en una paciente, prácticamente asintomática, primer caso de la literatura de una metástasis de un carcinoma ovárico en un pólipo endocervical (16) (fig. 12). El tumor primitivo resultó un carcinoma seroso papilar de la superficie del ovario (fig. 13), neoplasia de gran agresividad. Malle y col. refieren un segundo caso de metástasis cervical de un adenocarcinoma de ovario, diagnosticado en extendido cervicovaginal (17).

Fig. 12. Extendido cervical de metástasis en pólipo endocervical de carcinoma papilar seroso de la superficie del ovario.

Fig. 13. Histopatología del carcinoma seroso papilar de la superficie del ovario